我院陈红波及程芳研究团队联合佛山市第一人民医院罗微研究团队在Advanced Healthcare Materials上发表论文
近日,我院陈红波及程芳研究团队联合佛山市第一人民医院罗微研究团队在Advanced Healthcare Materials发表了题为“Dual-Targeting Nanovesicles Carrying CSF1/CD47 Identified from Single-Cell Transcriptomics of Innate Immune Cells in Heart Transplant for Alleviating Acute Rejection”的研究论文(frontispiece paper)。
目前临床上常用的免疫抑制剂主要靶向获得性免疫细胞T细胞发挥作用,比如抑制经典的T细胞活化信号通路“Calcineurin -NFAT”的药物环孢霉素A和他克莫司。该研究团队前期也围绕T细胞提出“细胞核仁可作为免疫抑制剂开发新靶点”的新观点和初步揭示了免疫检查点分子在T细胞免疫耐受建立中的作用,并基于此拓展了一个抗癌“老药”CX5461的免疫抑制剂新用途,开发了系列免疫检查点细胞纳米囊泡新型免疫抑制剂(J Extracell Vesicles. 2019; ACS Nano. 2020,副封面文章; EMBO Mol Med. 2021;Biomater Sci. 2021, 封面文章; Advanced Science. 2021,副封面文章; Acta Biomater. 2022; J Extracell Vesicles. 2023)。
现在越来越多的证据表明先天免疫细胞群对器官移植排斥发生或免疫耐受建立都发挥着至关重要的作用。比如有研究表明,即便经过大量的T细胞免疫抑制治疗,其先天免疫反应仍高度激活,病理上可见大量巨噬细胞浸润。然而,目前对先天免疫系统在心脏移植免疫排斥发生发展中的作用和分子机制还缺乏全面了解,临床上也还缺乏针对先天免疫系统的靶向抑制手段。因此临床上还迫切需要全面揭示心脏移植免疫排斥发生发展过程中各种先天性免疫细胞动态变化过程及其功能和作用机制,以及鉴定新的重要治疗靶点,开发更加安全有效的靶向先天性免疫细胞的抗免疫移植排斥药物或方案。
在此研究中,作者对心脏移植早期不同天数移植心脏进行了单细胞转录组测序,初步揭示了中性粒细胞和巨噬细胞动态变化规律,以及发现了与中性粒细胞相关的CSF1分子和与巨噬细胞吞噬相关的CD47分子可以作为免疫抑制剂开发靶点。基于上述发现机制,构建了一种基于IFN-γ刺激的iPSCs-MSC细胞膜起源的CSF1/CD47双靶点细胞外囊泡(CSF1/CD47 NVs),其可有效模仿中性粒细胞与巨噬细胞互作,促进单核细胞向抑制性巨噬细胞极化,并显著抑制心脏移植免疫排斥。总之,本研究开发的针对先天免疫细胞的新型免疫抑制剂具有重要的应用前景。
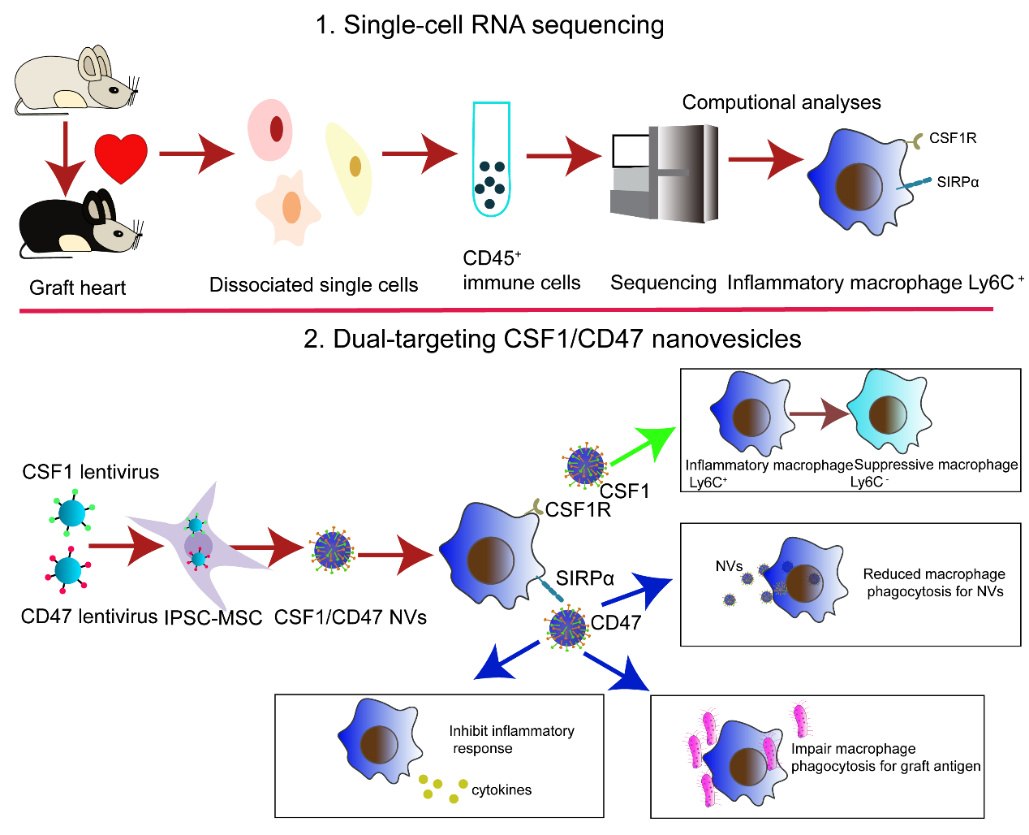
图1 CSF1/CD47双靶点细胞外囊泡抑制早期心脏移植排斥反应的流程图
为了揭示心脏移植急性免疫排斥发生发展过程中先天性免疫细胞动态变化,作者前期在移植后0、3和5天利用颈部异位心脏移植排斥模型结合单细胞转录组测序技术,研究了心脏移植物内的CD45+免疫细胞。引起作者注意的是巨噬细胞和中性粒细胞两个细胞群的变化趋势。统计学分析显示在移植第三天,首先是中性粒细胞迅速浸润到移植心脏部位;然而在移植的第五天,随着Ly6G-Ly6C+ M1型炎性巨噬细胞比例的大幅增加,中性粒细胞的比例呈显著下降趋势。
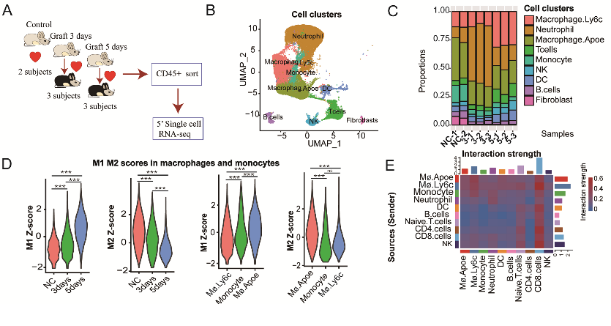
图2 单细胞测序分析巨噬细胞和中性粒细胞在心脏移植排斥早期的动态变化
中性粒细胞和巨噬细胞的显著相反变化趋势表明它们在心脏移植免疫排斥环境的形成中起着关键作用。首先,作者通过transwell实验筛选证明炎性巨噬细胞释放的cxcl2趋化因子减少导致移植第五天中性粒细胞浸润减少。进一步通过对炎性巨噬细胞和中性粒细胞互作信号分析发现与巨噬细胞极化功能密切相关的CSF1/CSF1R信号通路。通过配体与受体作用的免疫细胞的可视化网络图证明CSF1是由中性粒细胞释放作用到巨噬细胞。作者的检测结果也表明在移植第五天的小鼠心脏样本中CSF1水平显著下降。因此提出了中性粒细胞向移植心脏部位趋化减少引起的CSF1因子局部水平显著降低可能是造成单核巨噬细胞无法向M2型抑制性巨噬细胞极化的重要因素之一。
同时利用单细胞转录组数据对Ly6G-Ly6C+ M1型炎性巨噬细胞的表面基因进行分析发现与巨噬细胞吞噬相关SIRPα/CD47信号通路。文献报道细胞表达的CD47能够结合巨噬细胞表达的SIRPα启动巨噬细胞的抑制吞噬信号。值得注意的是,对移植心脏样本进行检测发现CD47分子表达水平在移植第三天就开始显著下降,这证明Ly6G-Ly6C+ M1型炎性巨噬细胞在心脏移植过程中的吞噬作用不断增强,这可能也是引起Ly6G-Ly6C+ M1型炎性巨噬细胞分化增强,进而诱发免疫排斥的重要原因。
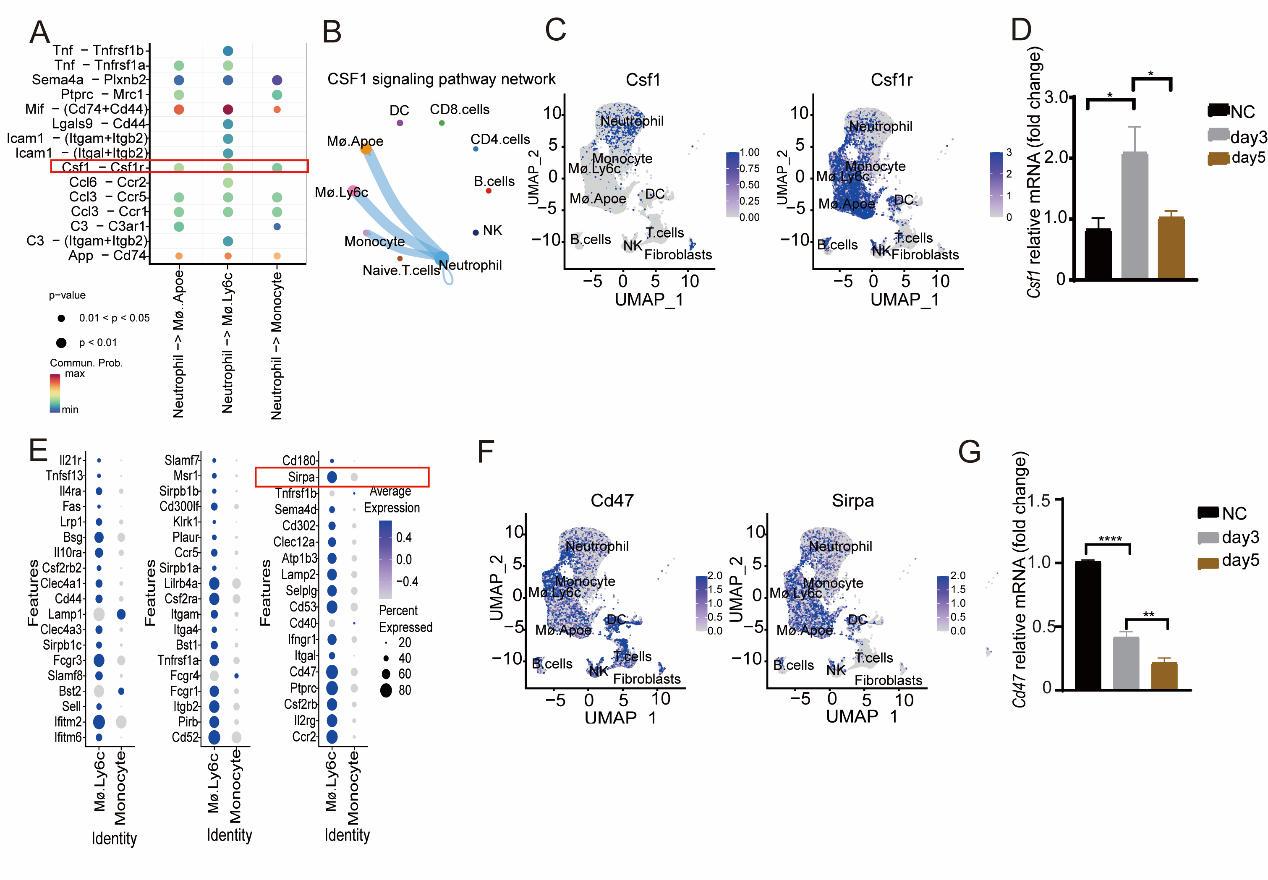
图3 筛选CSF1和CD47作为治疗心脏移植排斥的作用靶点
基于上述发现机制,作者构建了一种基于IFN-γ刺激的iPSCs-MSC细胞膜起源的CSF1/CD47双靶点细胞外囊泡。体外实验证明CSF1/CD47 NVs能够和巨噬细胞表达的相应的配体CSF1R和SIRPα特异性结合,一方面通过增强CSF1/CSF1R信号通路促进向Ly6G-Ly6C-M2型抑制性巨噬细胞分化;另一方面通过增强CD47/SIRPα信号通路抑制巨噬细胞对细胞外囊泡吞噬作用延长CSF1的作用时间,同时也抑制单核巨噬细胞对移植物抗原的吞噬和抗原呈递作用。
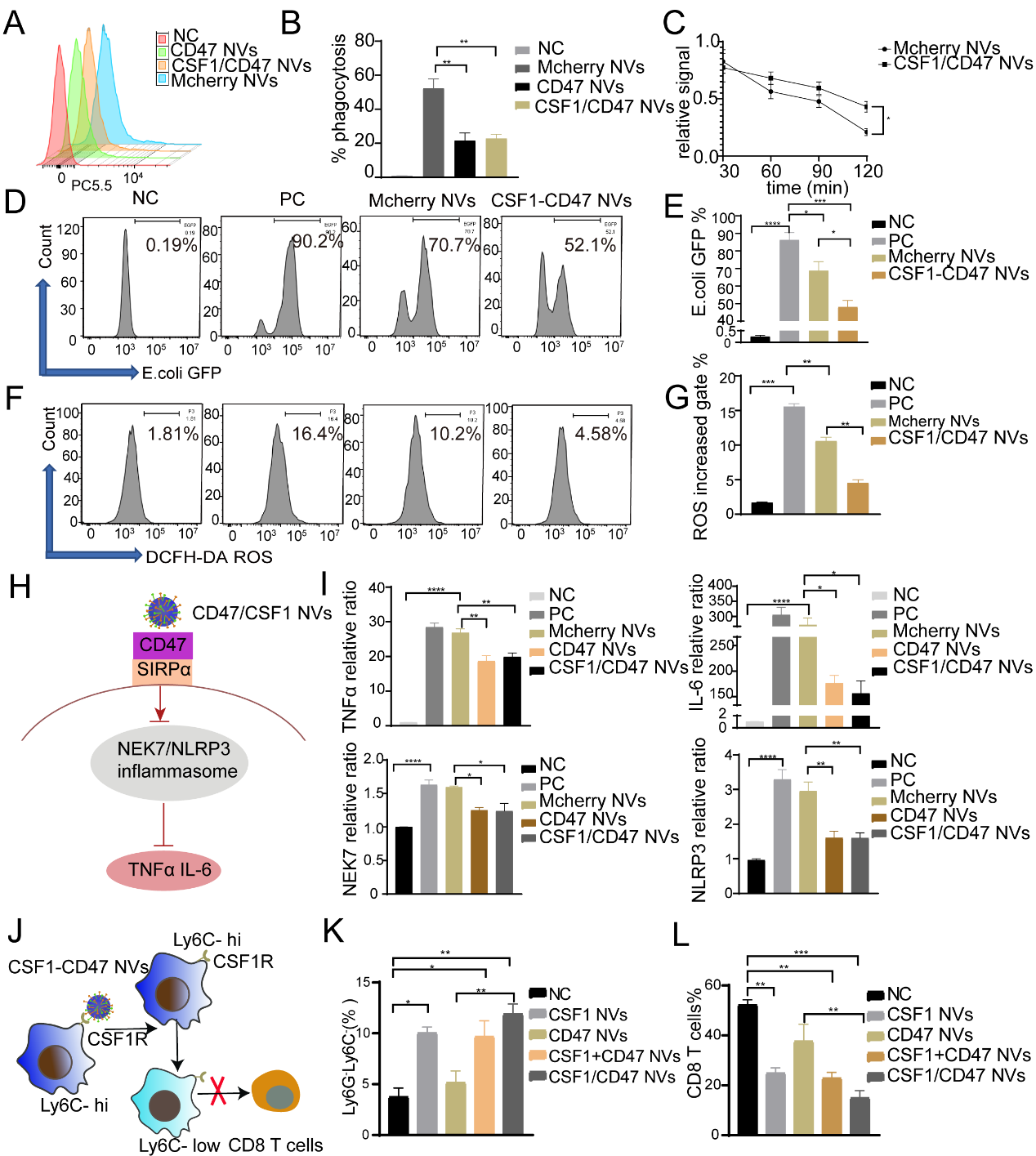
图4 体外实验证明CSF1/CD47 NVs的功能
最后,作者在动物体内评估双靶点囊泡CSF1/CD47 NVs在小鼠心脏移植排斥中的作用效果。结果证明CSF1/CD47 NVs促进移植心脏中炎性Ly6G-Ly6C+巨噬细胞向Ly6G-Ly6C-免疫抑制性巨噬细胞极化、抑制CD8+ T细胞以及延长心脏移植生存曲线。
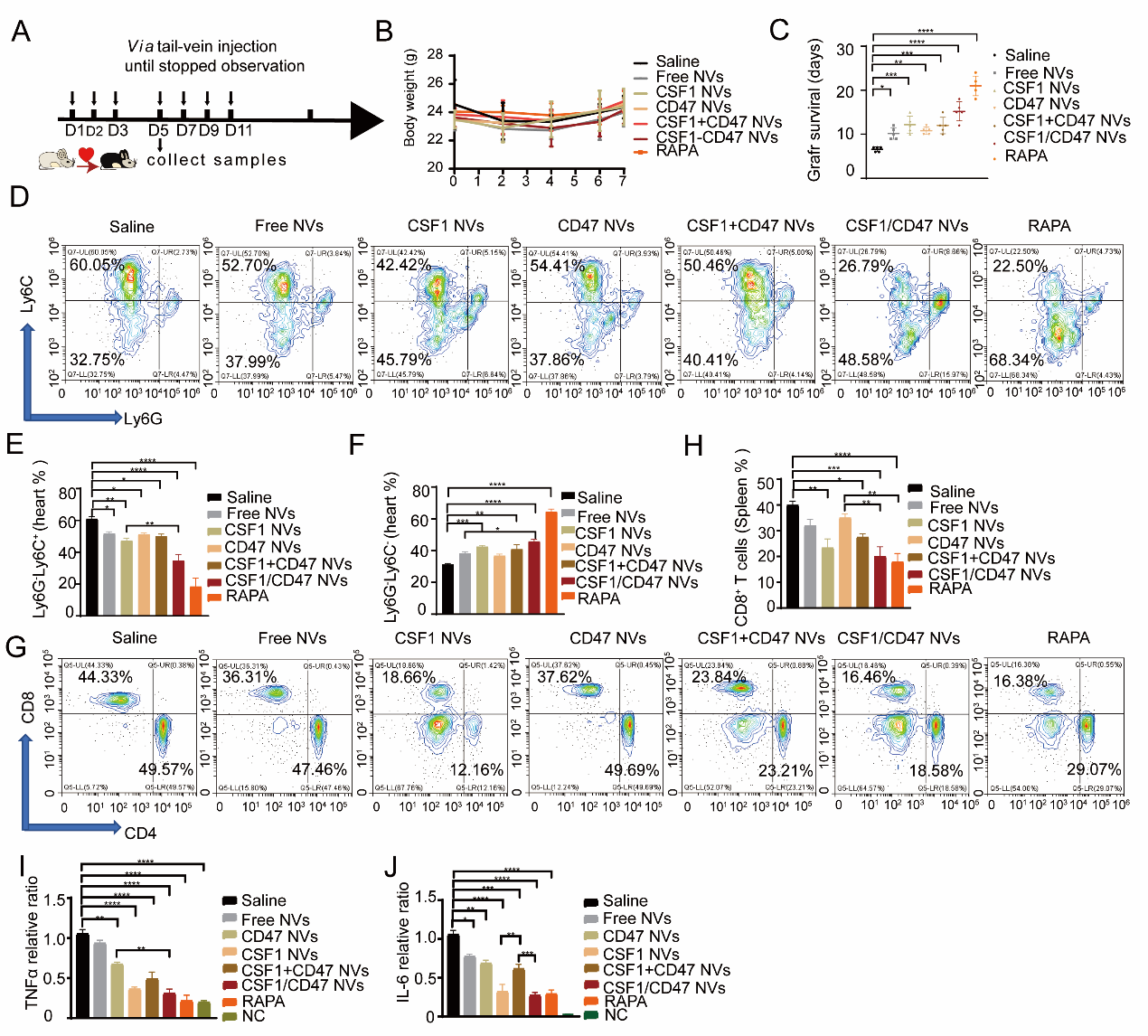
图5 体内实验证明CSF1/CD47 NVs缓解移植心脏
综上所述,通过单细胞转录组学测序发现了器官移植早期先天性免疫细胞的动态变化规律,揭示了免疫排斥早期单核巨噬细胞分化的分子机制,并基于此开发了CSF1/CD47双靶点细胞外囊泡新型先天性免疫细胞靶向抑制剂。
中山大学药学院(深圳)陈红波和程芳团队、佛山市第一人民医院罗薇研究员为论文的共同通讯。中山大学药学院(深圳)徐占雪博士和佛山市第一人民医院毛晓帆博士为论文的共同第一作者。上述研究得到了国家重点研发计划、国家自然科学面上项目、广东省自然科学基金面上项目、深圳市科创委基础研究重点项目和中国博士后基金等多个项目的支持。
文章信息
Dual-Targeting Nanovesicles Carrying CSF1/CD47 Identified from Single-Cell Transcriptomics of Innate Immune Cells in Heart Transplant for Alleviating Acute Rejection. Adv Healthc Mater. 2023 Nov 14:e2302443. doi: 10.1002/adhm.202302443.



