我院高艳锋课题组开发可高效口服递送PD-1/PD-L1阻断肽并诱导肿瘤铁死亡的鱼油微乳
近期,我院高艳锋教授团队在《Journal of Controlled Release》期刊2024年第365期上发表了题为“Fish oil-based microemulsion can efficiently deliver oral peptide blocking PD-1/PD-L1 and simultaneously induce ferroptosis for cancer immunotherapy”的研究论文。近年来,免疫检查点多肽类抑制剂备受关注,但难以口服限制了多肽类药物的进一步应用。基于此,研究人员在本文中首次开发了一种基于鱼油的微乳液用于PD-1/PD-L1阻断肽的口服递送。该绿色健康的微乳制剂不仅能显著提高多肽药物的口服生物利用度,还能诱导肿瘤细胞铁死亡,从而与PD-1/PD-L1阻断肽OPBP-1发挥协同抗肿瘤作用。因此,鱼油微乳制剂有望为肿瘤免疫治疗的功能性口服系统提供新的选择。
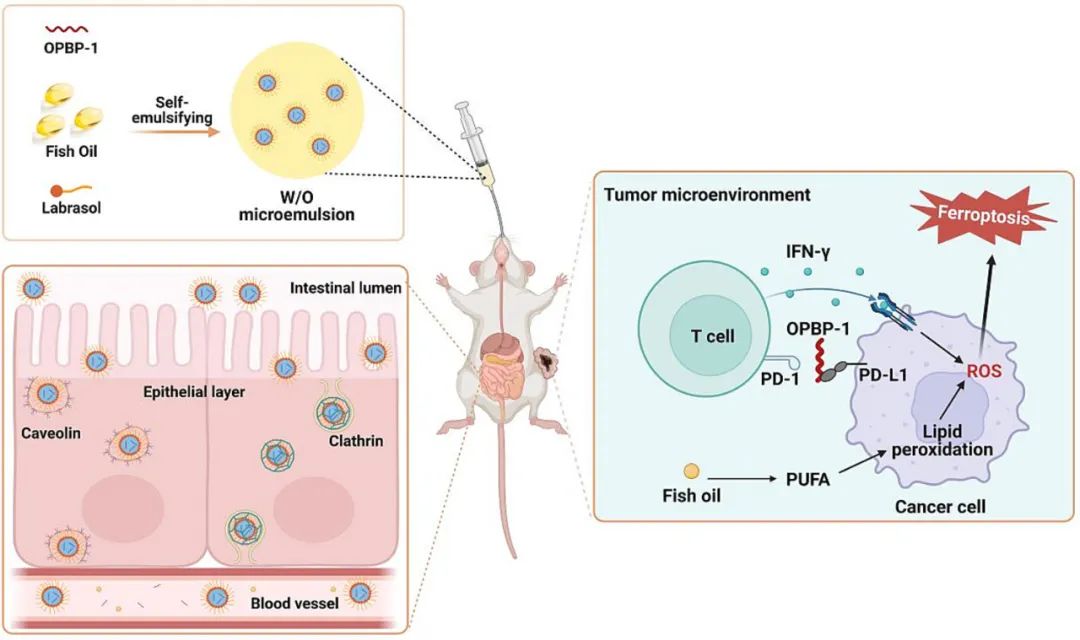
图形摘要
多肽药物因成本低、亲和力高、低毒性等优势,在药物研发中占据重要地位。多肽药物面临的瓶颈问题在于体内半衰期短、需频繁注射给药。口服是一种顺应性较强的给药方式,实现多肽药物的口服给药,是该领域面临的重大挑战。多肽难以口服的主要原因包括容易被胃肠道酶降和肠道渗透性差等[1],人们常通过加入蛋白酶抑制剂、肠道吸收促进剂等方法提高多肽药物的口服吸收[2-3],但这些方法可能会存在一定程度的副作用,探索更加安全、有效的多肽药物口服递送系统是非常必要的[4]。
微乳制剂具有制备简易和稳定性好的优势,其主要成分为脂质,能够很好地促进水溶性药物的肠道吸收[5]。鱼油是一种天然、绿色且安全的膳食油脂,富含ω-3和ω-6多不饱和脂肪酸,具有降低血脂、修复肠道紧密连接、抗肿瘤等多种益处[6],是制备口服多肽微乳的理想原料。因此,本研究以鱼油为原料,以PD-1/PD-L1阻断肽OPBP-1为模式多肽,制备了一种绿色健康的口服多肽鱼油微乳,并从体内外水平分别验证了该鱼油微乳的安全性和有效性。其表征如图1所示,鱼油微乳呈150nm左右的均匀液滴,常温保存稳定性良好,且能够很好地缓释多肽药物。
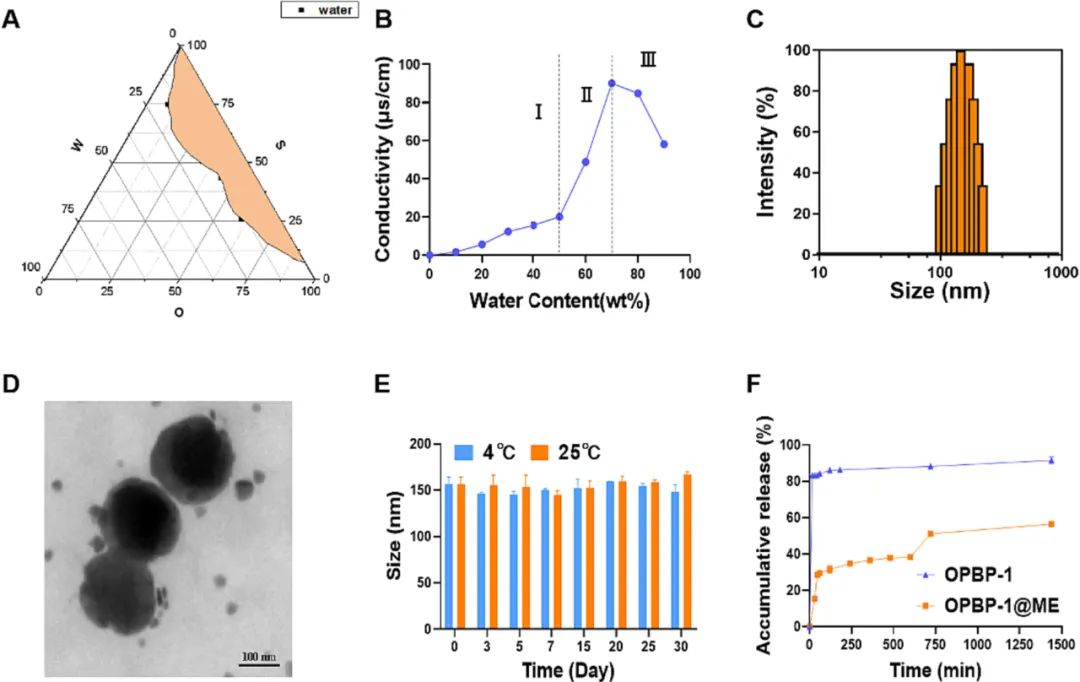
图1. 鱼油微乳的制备及表征
进而,作者在细胞水平的实验发现鱼油微乳能促进肠道上皮细胞对多肽的摄取,并且主要依赖的是网格蛋白和小窝蛋白所介导的内吞作用。将多肽鱼油微乳进行小鼠灌胃,发现其在体内胃肠道的极端环境中仍然能够显著促进多肽的肠道吸收。大鼠的体内药代动力学实验表明,鱼油微乳让多肽药物的口服生物利用度提高了4.1倍左右,半衰期提高了近10倍(图2)。
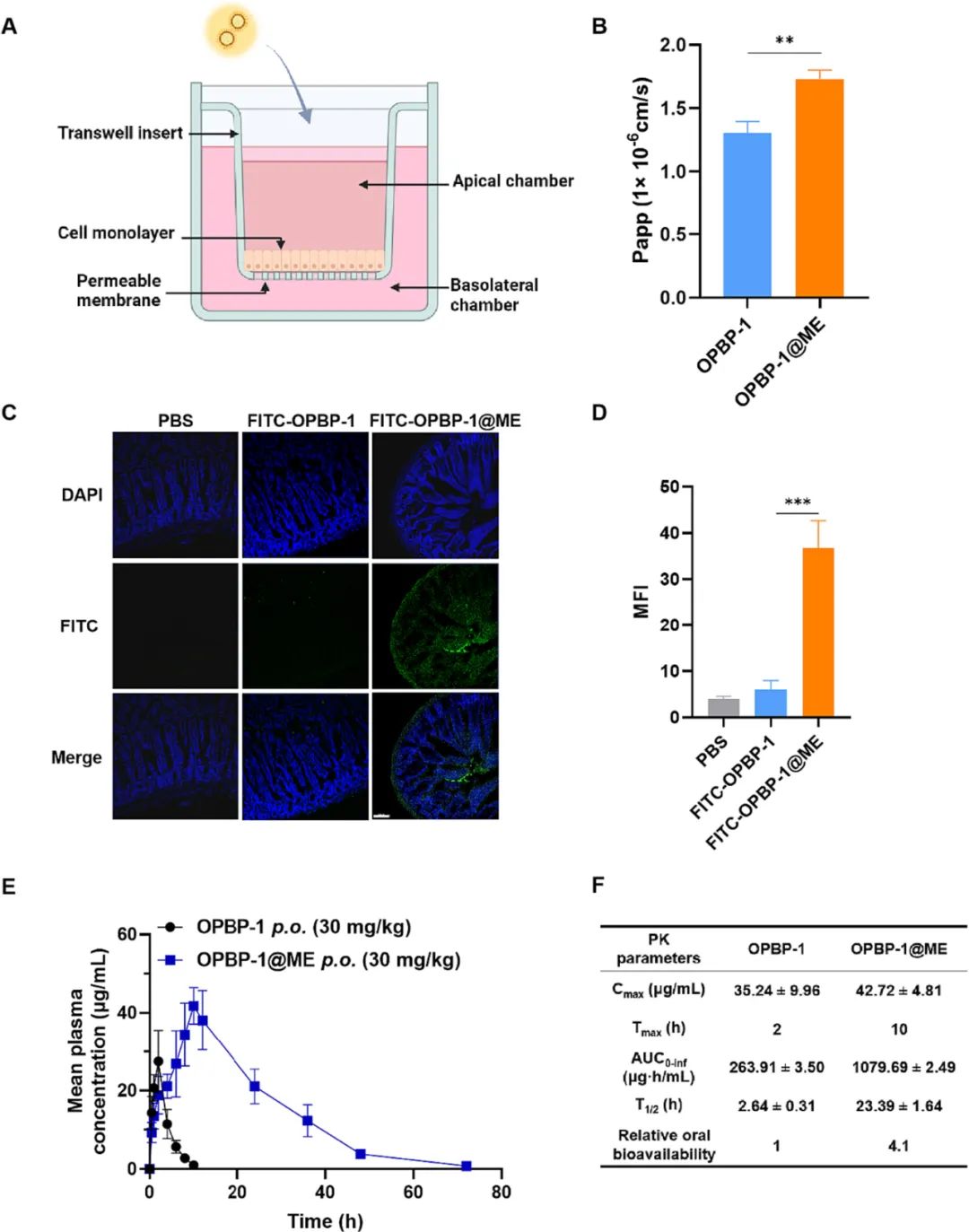
图2. 鱼油微乳能有效促进多肽药物的吸收
由于鱼油微乳包载的多肽OPBP-1为PD-1/PD-L1阻断肽,接下来,作者在动物水平验证了鱼油微乳能否口服递送多肽抗肿瘤。结果如图3所示,口服OPBP-1鱼油微乳均能显著抑制CT26肿瘤的生长,而单独口服OPBP-1裸肽没有明显的抗肿瘤效果。其次,空载鱼油微乳组小鼠肿瘤生长也受到一定程度的抑制,说明单独的鱼油也有抗肿瘤活性。鱼油微乳作为载体在促进OPBP-1多肽口服吸收的同时,也能够与PD-1/PD-L1阻断肽协同抑制肿瘤的生长。
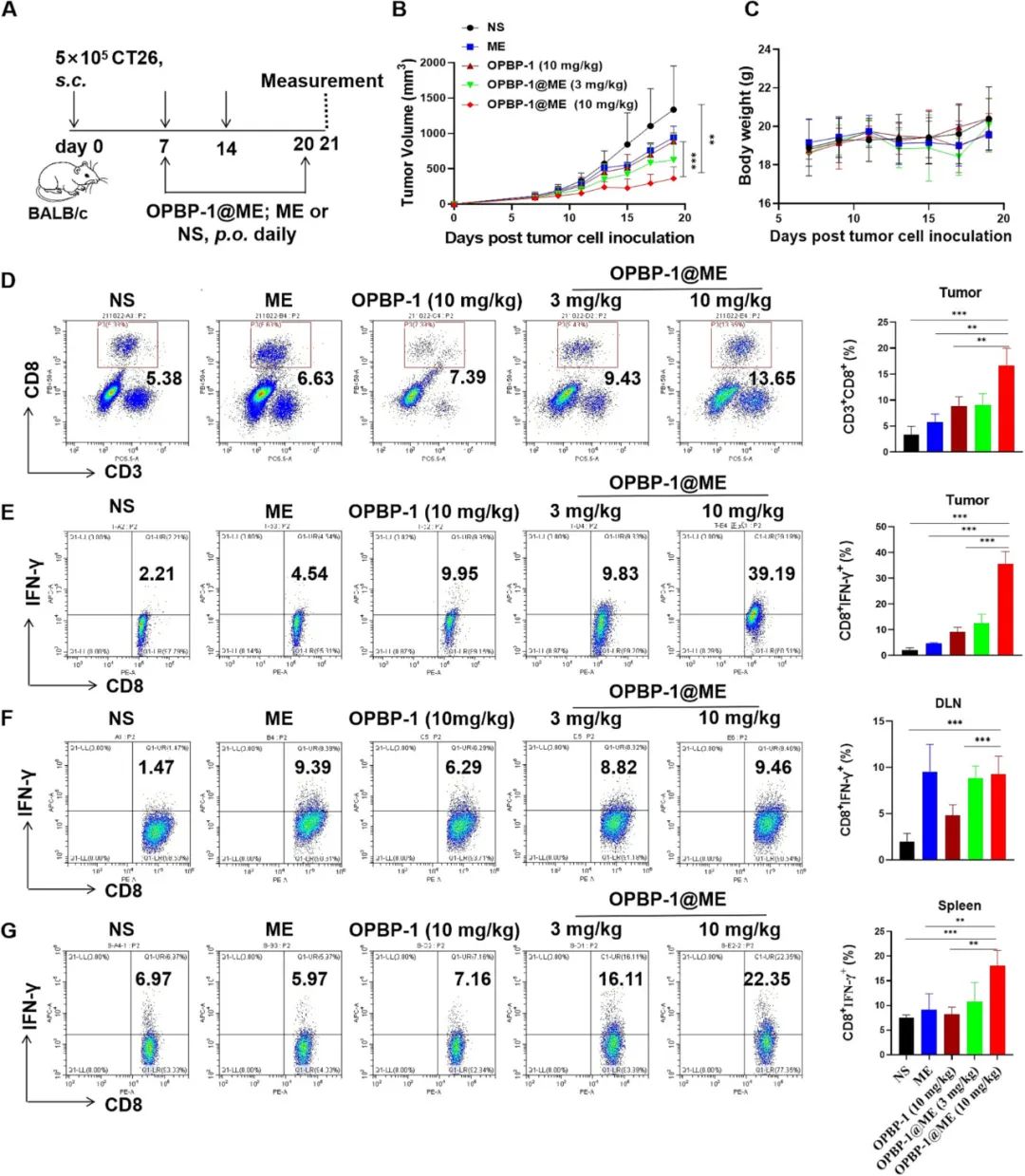
图3. OPBP-1鱼油微乳显著抑制小鼠肿瘤的生长
最后,作者对鱼油的抗肿瘤机制进行了探索。由于鱼油富含多不饱和脂肪酸,而多不饱和脂肪酸堆积导致的脂质过氧化已被报道是细胞铁死亡的诱因[7]。因此,铁死亡可能是鱼油抗肿瘤的重要原因。结果如图4所示,鱼油可以显著增加肿瘤细胞中ROS的产生,并且这种ROS的产生可以被铁死亡抑制剂抑制,且铁死亡抑制剂可以显著降低鱼油所导致的肿瘤细胞死亡,并与IFN-γ协同促进肿瘤细胞铁死亡。这些结果均表明,鱼油可以通过诱铁死亡抑制肿瘤生长,并与CD8+T细胞产生的IFN-γ协同发挥抗肿瘤作用。
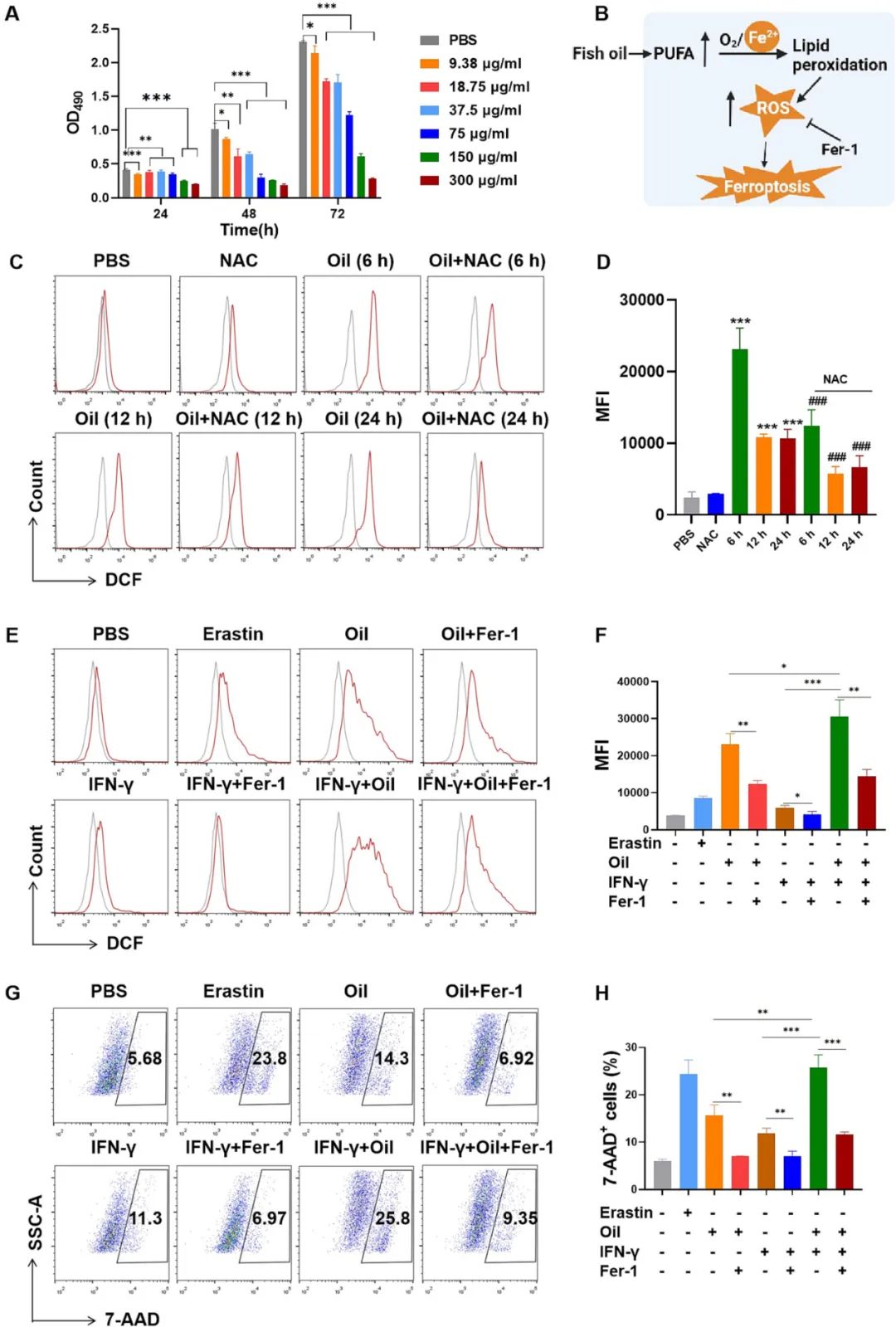
图4. 鱼油可协同IFN-γ促进肿瘤细胞铁死亡
综上所述,本研究基于绿色健康的鱼油制备了多肽口服递送的微乳制剂,显著提高了多肽药的口服生物利用度和半衰期,且能够促进肿瘤细胞发生铁死亡,并与OPBP-1多肽协同抗肿瘤。
研究亮点
1.鱼油微乳绿色健康、制备简易,不需要任何辅助表面活性剂,可显著提高多肽药物的口服生物利用度;
2.这种微乳制剂通过网格蛋白和小窝蛋白介导的内吞作用促进多肽药物在肠上皮细胞的渗透;
3.鱼油可以促进肿瘤细胞铁死亡,并且与CD8+T细胞产生的IFN-γ协同发挥抗肿瘤效果。
文章信息
Volume 365, January 2024, Pages 654-667
https://doi.org/10.1016/j.jconrel.2023.11.042
作者信息
通讯作者
1.高艳锋,中山大学药学院(深圳)“百人计划”教授、博士生导师。主要从事肿瘤免疫与药物化学的交叉领域研究,包括肿瘤免疫治疗多肽药物筛选、多肽疫苗设计、多肽口服递送等。百千万人才工程国家级人选、国家有突出贡献中青年专家、享受国务院政府特殊津贴专家和国家优青基金获得者。
2.陈冠宇,中山大学药学院(深圳)副教授、深圳海外高层次人才,曾担任新西兰及美国多个药企的研究员。主要从事药剂学和肿瘤免疫交叉领域研究。
第一作者
1.杨欣,中山大学药学院(深圳)博士研究生,研究方向为肿瘤免疫与多肽药物。
2.李琬琼,中山大学博士后,研究方向为肿瘤免疫与多肽药物。
参考资料
[1] L. Wang, N. Wang, W. Zhang, X. Cheng, Z. Yan, G. Shao, X. Wang, R. Wang, C. Fu, Therapeutic peptides: current applications and future directions, Signal Transduct Target Ther, 7 (2022) 48. 10.1038/s41392-022-00904-4.
[2] D.J. Brayden, T.A. Hill, D.P. Fairlie, S. Maher, R.J. Mrsny, Systemic delivery of peptides by the oral route: formulation and medicinal chemistry approaches, Adv Drug Deliv Rev, 157 (2020) 2-36. 10.1016/j.addr.2020.05.007
[3] D.J. Drucker, Advances in oral peptide therapeutics, Nat Rev Drug Discov, 19 (2020) 277-289. 10.1038/s41573-019-0053-0.
[4] G. Chen, D. Svirskis, W. Lu, M. Ying, Y. Huang, J. Wen, N-trimethyl chitosan nanoparticles and CSKSSDYQC peptide: N-trimethyl chitosan conjugates enhance the oral bioavailability of gemcitabine to treat breast cancer, J Control Release, 277 (2018) 142-153. 10.1016/j.jconrel.2018.03.013.
[5] N. Anton, J.P. Benoit, P. Saulnier, Design and production of nanoparticles formulated from nano-emulsion templates-a review, J Control Release, 128 (2008) 185-199. 10.1016/j.jconrel.2008.02.007.
[6] B. Ravić, J. Debeljak-Martacić, B. Pokimica, N. Vidović, S. Ranković, M. Glibetić, P. Stepanović, T. Popović, The effect of fish oil-based foods on lipid and oxidative status parameters in police dogs, Biomolecules, 12 (2022). 10.3390/biom12081092.
[7] A.J. Cockbain, G.J. Toogood, M.A. Hull, Omega-3 polyunsaturated fatty acids for the treatment and prevention of colorectal cancer, Gut, 61 (2012) 135-149. 10.1136/gut.2010.233718.



