中山大学“百人计划”引进人才,副教授。入选教育部海外引才专项,深圳“鹏城孔雀计划”特聘岗位人才 (C档),2019年博士毕业于厦门大学,师从吴川六教授,随后在美国伊利诺伊大学香槟分校从事博士后研究,2023年2月受聘为中山大学药学院(深圳)副教授。主要从事肽类天然产物生物合成途径解析及其酶学机制研究,噬菌体展示非天然多肽库,多肽识别分子的设计与筛选以及酶定向进化等研究。近年以第一作者在Nat. Chem. Biol、Nat. Commun、JACS、Chem. Sci、ACS Catal、Acc. Chem. Res.等学术期刊上发表多篇学术论文。
电子邮箱:zhengyw53@mail.sysu.edu.cn
课题组网站:https://yxysz.sysu.edu.cn/ywzhenglab/index.htm
电子邮箱
zhengyw53@mail.sysu.edu.cn
研究方向
1.生物合成肽类天然产物及其酶学机制研究。综合多种学科的研究方法(包括生物化学,结构生物学,分子生物学和化学等),对具有显著生物学功能的复杂肽类天然产物开展生物合成的机制研究。通过生物信息学的方法确定完整的生物合成基因簇,建立基本的生物合成途径,利用X射线晶体衍射技术和冷冻电镜技术对一些独特结构单元的形成进行酶学机制研究,进一步对生物合成路径进行遗传修饰,从而拓展化学结构和功能的多样性。
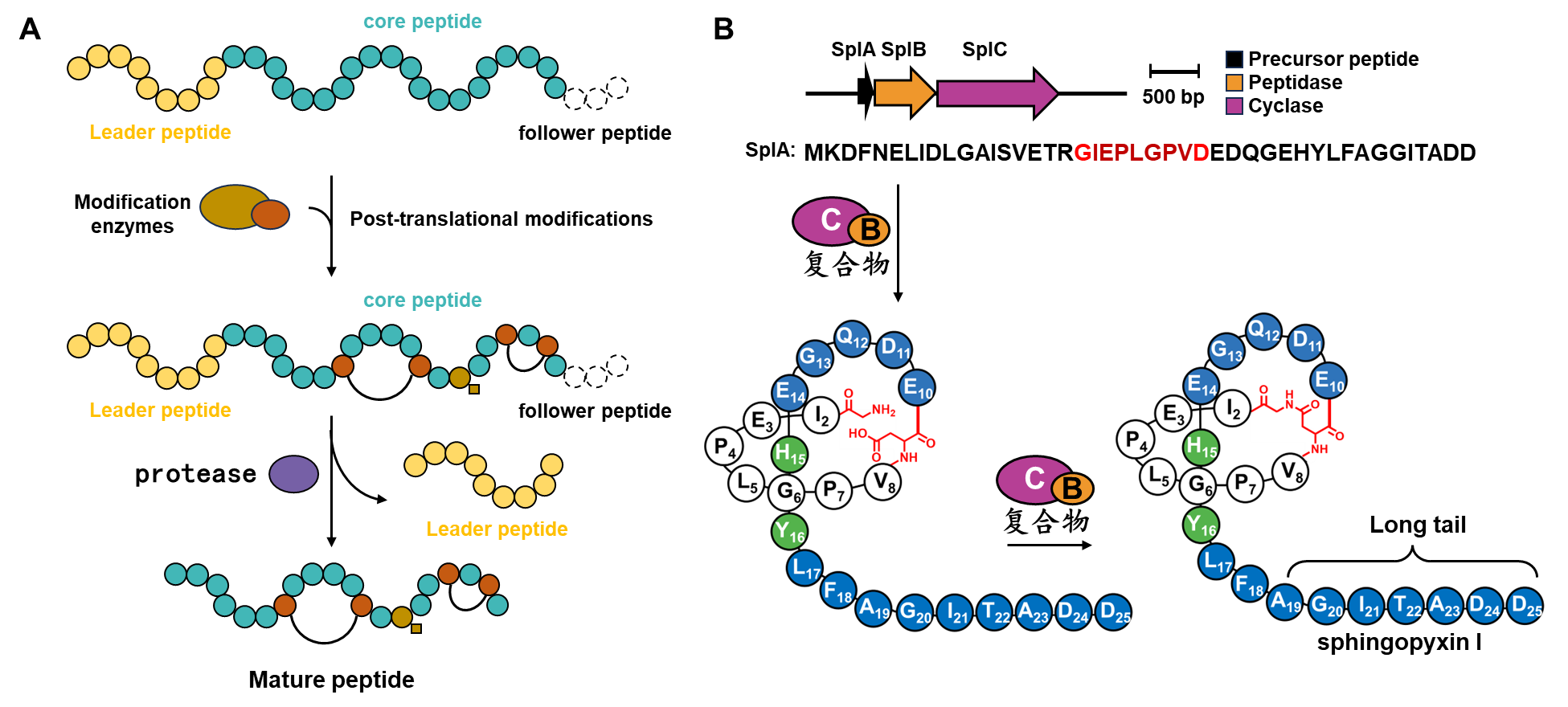
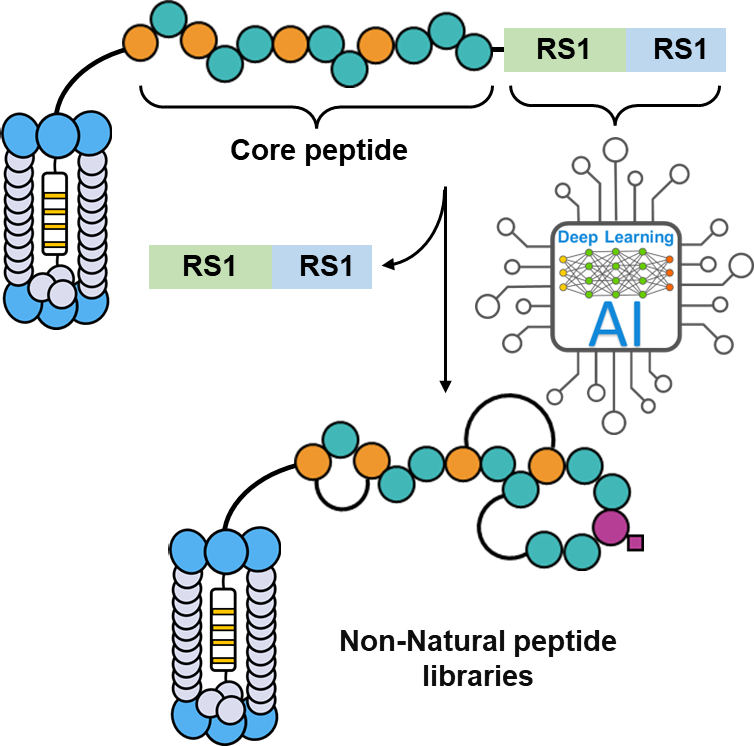
2.深度学习噬菌体展示非天然多肽库。自 George P. Smith 等人首次开创噬菌体展示技术以来,多肽药物分子的筛选便进入了一个崭新的时代。许多结构新颖的多肽药物被成功地筛选并应用于疾病的治疗。尽管如此,噬菌体局限于展示由20种天然氨基酸构成的多肽库,限制了其用于筛选复杂结构的靶标蛋白。我们致力于将肽类天然产物的生物合成途径与噬菌体展示技术相结合,通过深度学习模型评估酶的修饰效率,从而在噬菌体展示的天然肽库中高效引入各种结构复杂的非天然构建块,最终实现噬菌体展示类天然产物多肽库。
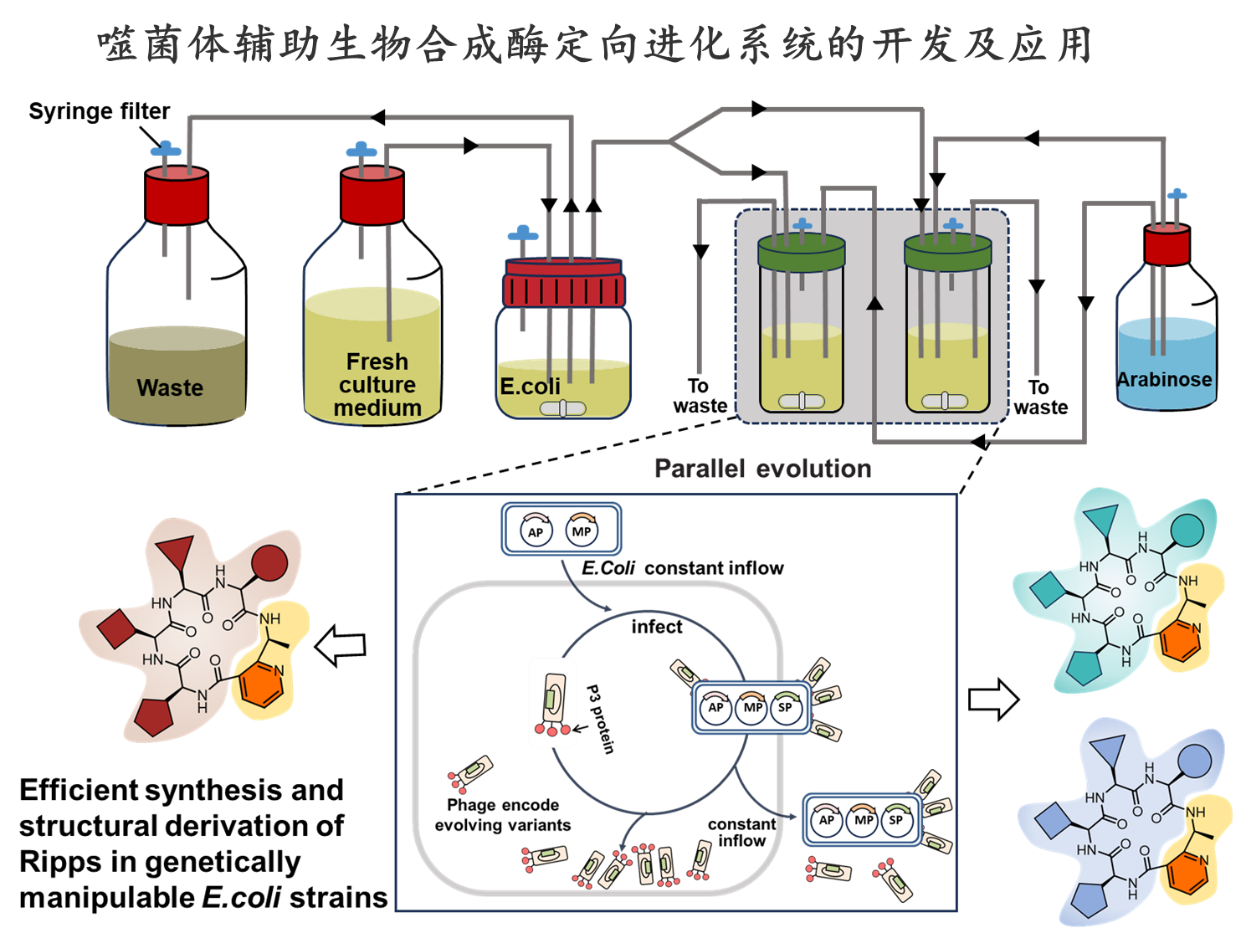
3.噬菌体辅助生物合成酶定向进化系统的开发及应用。癌症和传染病严重威胁人类的公共卫生健康,随着临床上耐药性的出现,这一问题愈发严重。天然产物常常呈现出极其复杂的结构多样性和生物活性,在化学生物学的研究以及创新型药物的研发等领域均发挥重要的作用。然而其结构复杂性挑战当前有机化学合成方法,课题组目前正在开发噬菌体辅助肽类天然产物生物合成系统,旨在遗传操作简单的大肠杆菌中实现核糖体肽类天然产物的高效合成及结构衍生,通过微生物合成体系的优越性解决化学合成方法在创造复杂肽类天然产物结构多样性的不足。在丰富核糖体肽类天然产物多样性的同时,开展抗肿瘤和抗菌活性的研究。
科研项目
【08】2025-2027 国家重点研发计划项目,1400万(承担:120万),核心成员。
【07】2025-2028国自然基金面上项目,主持。
【06】2025-2027 深圳市基础研究重点项目,核心成员。
【05】2024-2026 教育部海外引才专项,主持。
【04】2024-2026 深圳市医学研究专项青年项目,主持。
【03】2024-2026 国家自然科学基金青年项目,主持。
【02】2023-2024 中央高校青年教师培育项目,主持。
【01】2023-2026 中山大学“百人计划”启动项目,主持。
代表论著
1.Yiwu Zheng, Satish K. Nair*, YcaO-mediated ATP-dependent peptidase activity in ribosomal peptide biosynthesis. Nat. Chem. Biol. 2023, 19, 111–119.
2.Yiwu Zheng, Chayanid Ongpipattanakul, Satish K. Nair*, A Bioconjugate Platform for Iterative Backbone N-Methylation of Peptides. ACS Catal. 2022, 12, 22, 14006-14014
3.Yiwu Zheng, Ying Cong, Eric W. Schmidt, Satish K. Nair*, Catalysts for the Enzymatic Lipidation of Peptides. Acc. Chem. Res. 2022, 55, 1313–1323.
4.Sicong Yao, Adam Moyer, Yiwu Zheng (共同一作), Yang Shen, Xiaoting Meng, Chong Yuan, Yibing Zhao, Hongwei Yao, David Baker, Chuanliu Wu, De novo design and directed folding of disulfide-bridged peptide heterodimers. Nat. Commun. 2022, 13, No. 1539.
5.Yiwu Zheng, Yang Shen, Xiaoting Meng, Yaqi Wu, Yibing Zhao*, and Chuanliu Wu*, Stabilizing p-dithiobenzyl Urethane Linkers without Rate-Limiting Self-Immolation for Traceless Drug Release, ChemMedChem, 2019, 14, 1196–1203.
6.Yiwu Zheng, Xiaoting Meng, Yaqi Wu, Yibing Zhao, and Chuanliu Wu*, De Novo Design of Constrained and Sequence-Independent Peptide Scaffolds with Topologically-Formidable Disulfide Connectivities, Chem. Sci. 2018, 9, 569–575.
7.Yiwu Zheng, Zhuoru Li, Jing Ren, Weidong Liu, Yaqi Wu, Yibing Zhao, and Chuanliu Wu*, Artificial Disulfide-Rich Peptide Scaffolds with Precisely Defined Disulfide Patterns and a Minimized Number of Isomers, Chem. Sci. 2017, 8, 2547−2552.
8.Yiwu Zheng, Jing Ren, Yaqi Wu, Xiaoting Meng, Yibing Zhao, and Chuanliu Wu*, Proteolytic Unlocking of Ultrastable Twin-Acylhydrazone Linkers for Lysosomal Acid-Triggered Release of Anticancer Drugs, Bioconjugate. Chem. 2017, 28, 2620−2626.
9.Yiwu Zheng, L. X. Zhai, Y. B. Zhao, and C. L. Wu*, Orthogonal Cysteine-Penicillamine Disulfide Pairing for Directing the Oxidative Folding of Peptides, J. Am. Chem. Soc. 2015, 137, 15094−15097.
10. Wenjia Gu, Yiwu Zheng, Taras Pogorelov, Satish K. Nair, Eric W. Schmidt. Control of Nucleophile Chemoselectivity in Cyanobactin YcaO Heterocyclases PatD and TruD. ACS Chem. Biol. 2022, 17,1215-1225
11.Huilei Dong, Xiaoting Meng, Xiaoli Zheng, Xueting Cheng, Yiwu Zheng, Yibing Zhao, Chuanliu Wu*, Design and Synthesis of Crosslink-Dense Peptides by Manipulating Regioselective Bisthioether Crosslinking and Orthogonal Disulfide Pairing, J. Org. Chem. 2019, 84, 5187-5194.
12.W. D. Liu, Yiwu Zheng, X. D. Kong, C. Heinis, Y. B. Zhao, C. L. Wu*, Precisely Regulated and Efficient Locking of Linear Peptides into Stable Multicyclic Topologies through a One-Pot Reaction, Angew. Chem. Int. Ed., 2017, 56, 4458−4463.



